철엔 왜 녹이 생길까?
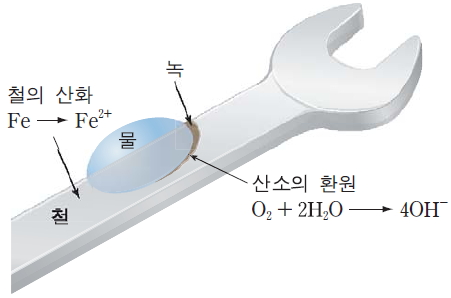
철이 녹이 되는 과정은 전기화학적 반응으로, 물과 산소가 함께 있을 때 철이 산화됩니다. 이 과정에서 철은 전자를 잃고 산소는 물 속에서 전자를 얻어 수산화 이온을 만듭니다. 이 수산화 이온은 철과 결합해 녹, 즉 산화철을 형성하게 됩니다. 특히 물에 염화나트륨이나 염화칼슘 같은 염이 녹아 있을 경우, 이온이 많아지면서 전자의 이동이 촉진되고 녹이 더 빨리 생깁니다. 그래서 바닷가나 제설제 사용 지역에서는 철이 더 쉽게 부식됩니다.

철은 습기가 포함된 공기에 노출되면 산화되어 Fe2+이 되고, 이때 산소가 환원되어 OH-이 됩니다.
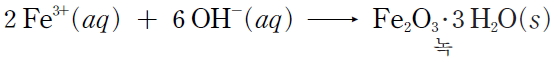
Fe2+은 공기 중의 산소와 물에 의해 더욱 산화되어 Fe3+이 되고, Fe3+이 OH-과 결합하여 녹의 성분인 산화 철(Ⅲ)이 생성됩니다.
부식 방지 및 관리방법은?

- 반응성이 작은 금속 도금 : 주석처럼 철보다 반응성이 낮은 금속을 도금하면, 금속이 물과 산소를 차단해 철이 부식되지 않도록 합니다. 그러나 도금층이 손상되거나 벗겨지면, 철이 더 쉽게 산소와 물에 노출되기 때문에 부식이 오히려 가속화되는 단점이 있습니다.
- 반응성이 큰 금속 도금 : 아연과 같은 철보다 반응성이 큰 금속을 도금할 경우, 아연이 먼저 산화되어 산화 피막을 형성합니다. 이 피막이 철을 보호하고, 도금층이 일부 벗겨지더라도 아연이 계속해서 철을 보호해 철의 부식을 지연시킵니다. 이것은 희생양극 방식이라 불리며, 철보다 반응성이 큰 금속이 먼저 산화되어 철을 보호하는 장점이 있습니다.
- 피막 형성 : 기름칠, 페인트칠, 방청유 등을 이용해 철 표면에 보호막을 형성하는 방법도 많이 사용됩니다. 이는 산소와 물의 접촉을 물리적으로 차단하여 부식을 방지합니다. 다만, 시간이 지나면서 피막이 손상되면 다시 부식의 위험이 생길 수 있습니다.
- 희생양극 보호 : 아연 외에도 마그네슘과 같은 더 반응성이 큰 금속을 철과 연결하면, 이 금속이 먼저 부식되어 철을 보호하는 역할을 합니다. 이는 주로 해양 구조물이나 배에서 사용되며, 철이 부식되는 것을 막아줍니다.